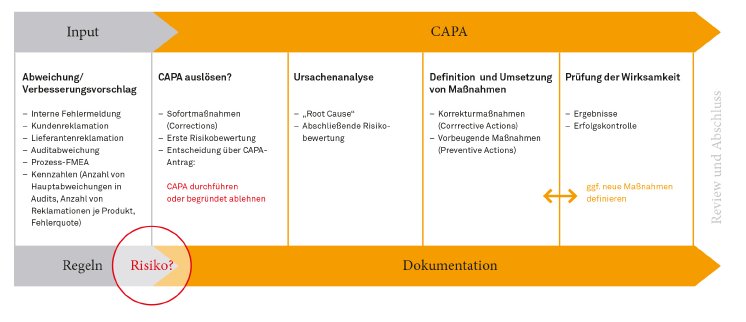
CAPA (Corrective Actions, Preventive Actions) bezeichnet die systematische Untersuchung von Abweichungen. Ziel ist es, ein erneutes Auftreten durch Korrektur- und Vorbeugemaßnahmen zu vermeiden. In der Medizintechnik ist der CAPA-Prozess durch regulatorische Vorgaben klar definiert, z. B. durch die amerikanische Food and Drug Administration (FDA). Die große Mehrheit der europäischen Medizintechnik-Hersteller liefert in die USA. Deshalb sind diese Richtlinien auch für sie verpflichtend. Für den häufig manuell durchgeführten Prozess gibt es jetzt eine neue Software-Lösung von Babtec.
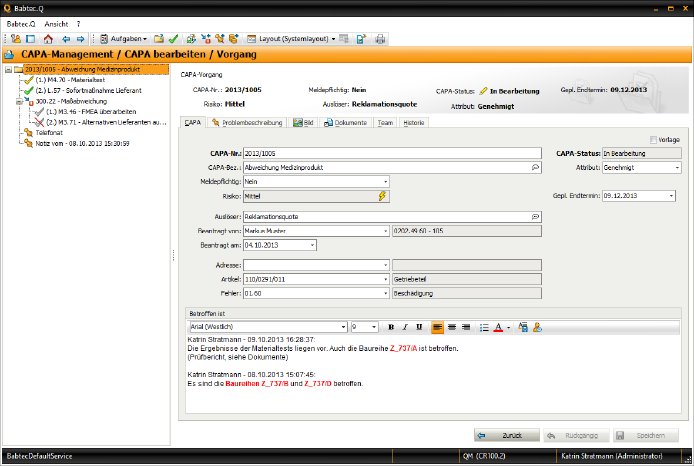
Das CAPA-Modul in der Software Babtec.Q garantiert die normkonforme Umsetzung der Vorgaben. Der gesamte CAPA-Prozess wird transparent und standardisiert abgebildet: Vorher festgelegte Regeln, Ereignisse oder Kennzahlen – z. B. Reklamationen oder Audit-Abweichungen – lösen den CAPA-Prozess aus. Es folgt die Analyse der Ursachen. Dank der strukturierten Vorgehensweise können diese schnell identifiziert und deren Risiken bewertet werden. Eine zeitnahe Umsetzung von wirksamen Korrekturmaßnahmen sowie von nachhaltigen Vorbeugemaßnahmen für die künftige Fehlervermeidung ist so gewährleistet. Wichtige Entscheidungen werden mit elektronischer Unterschrift und durch das integrierte Audit-Trail lückenlos und reproduzierbar in der CAPA-Historie protokolliert.
Das CAPA-Modul von Babtec vervollständigt den Qualitätsregelkreis und bietet dabei alle Vorteile einer integrierten QM-Lösung. Von diesem wirtschaftlichen Einsatz können auch andere Branchen profitieren: „Über die regulatorischen Aspekte in der Medizintechnik hinaus stärkt die strategische Umsetzung von CAPA-Management die kontinuierliche Qualitätsverbesserung“, sagt Michael Flunkert, Geschäftsführer der Babtec GmbH. „Indem man das Vorgehen bei der Fehlervermeidung systematisiert, kann Schaden effektiv abgewendet und das gesamte Unternehmen langfristig gestärkt werden.“